Комбинация различных генов и окружающая среда играют важную роль как в развитии и прогрессировании распространенных заболеваний (таких, как диабет, рак, болезни сердца, инсульт, депрессия и астма), так и в индивидуальной реакции на фармакологические препараты. Для идентификации генетических факторов этих заболеваний, можно в принципе получить полный сиквенс (нуклеотидную последовательность) необходимых генов группы здоровых и больных индивидуумов, а затем провести сравнительный анализ генетической последовательности двух групп.
До недавнего времени этот подход был неосуществим. Тем не менее, завершение проекта «Геном человека» в 2003 году дало возможность лучшего понимания этнического разнообразия и природы сложных заболеваний и индивидуальных реакций на препараты, что в свою очередь дало толчок развитию «персонализированной медицины».
С тех пор, стоимость сиквенирования генома резко упала. Поскольку сейчас мы в состоянии быстро и недорого сиквенировать полный геном, появляется возможность проводить всеобъемлющую, генетическую оценку рисков и персонализировать лечение.
Несмотря на то, что технический прогресс привел к значительному сокращению расходов на сиквенирование, остается неясным как интерпретировать и применять в клинических целях генетическую оценку рисков, основанной на генетической информации небольшого количества индивидуумов, полученной учеными в области генетики. Основная причина заключается в наличии скудной базы данных структурных генетических вариаций.
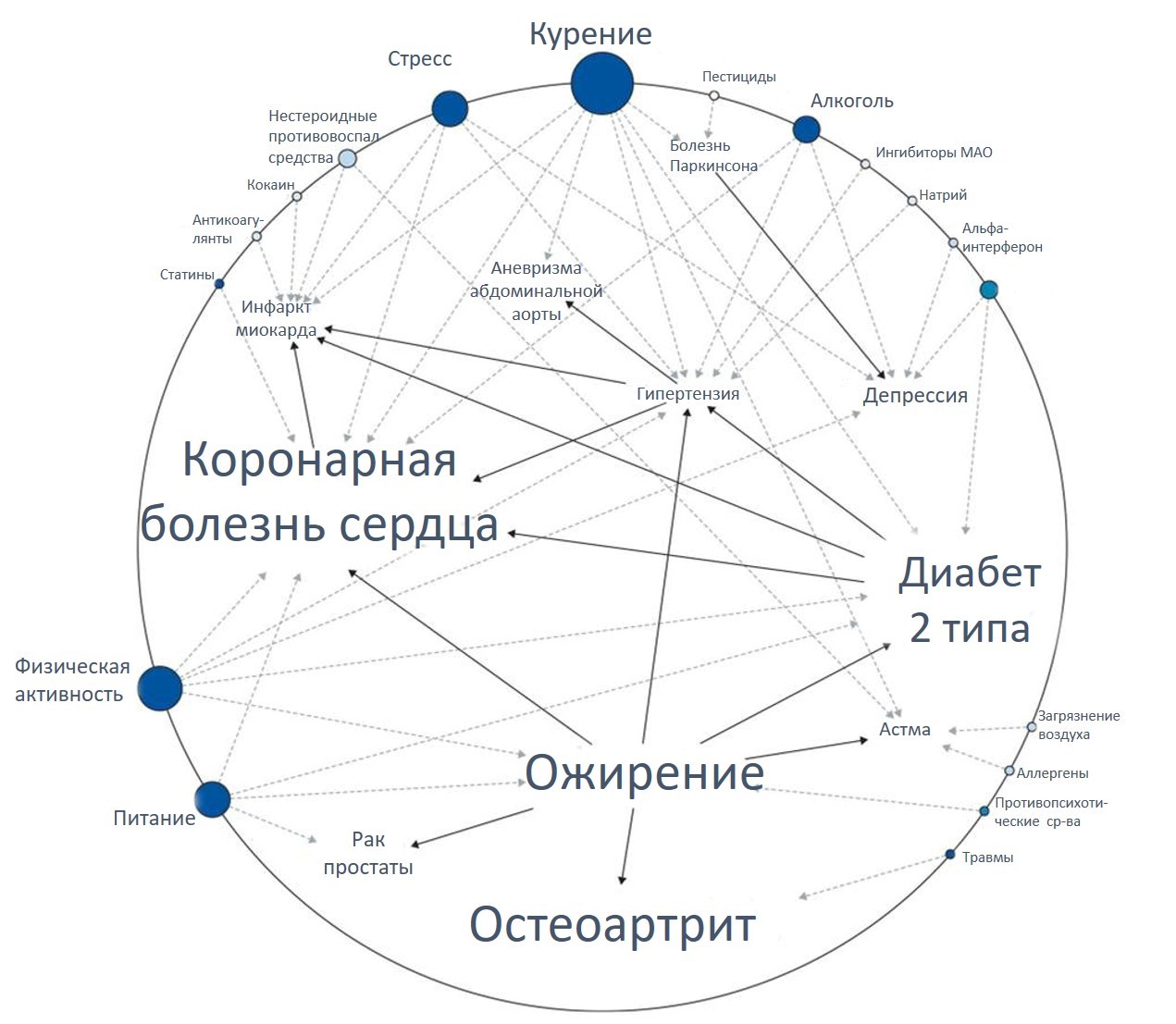
В последнее время результаты исследований открывают новые возможности для более успешного применения результатов анализа генетической информации в клинических целях. Ранее исследовательская группа под руководством доктора Ashley из университета Стэнфорда (Ashley et al, Lancet, May 2010) сообщила о сиквенсе генома 40-летнего индивидуума с наследственной предрасположенностью к сосудистым заболеваниям и к ранней внезапной смерти. Такие данные сиквенирования представляют собой клиническую ценность. Исследователи идентифицировали аллели генов, связанных с такими заболеваниями, имеющими место в семье человека как остеоартрит, сосудистые заболевания и ранняя внезапная смерть. Они также обнаружили аллели генов, связанные с заболеваниями, которые не наблюдались в его семье, такие как избыточное накопление железа, заболевания щитовидной и паращитовидной желез. Кроме того, информация о некоторых генах позволяет прогнозировать вероятную реакцию пациента на определенные лекарства против сердечных заболеваний. Эта информация особенно ценна, поскольку данный индивидуум предрасположен к сердечно-сосудистым заболеваниям.
По результатам исследования удалось разработать диаграмму, характеризующую генетические риски заболеваний данного конкретного пациента. На данной диаграмме размеры текста, которым обозначены болезни, соответствуют степени генетических рисков их развития. Сплошные стрелки указывают на взаимосвязь между болезнями, обусловленными генетическими факторами. Помимо генетических причин, важную роль в развитии заболеваний играют факторы окружающей среды. Они представлены по окружности диаграммы. Прерывистыми стрелками указаны направления, по которым факторы внешней среды влияют на те или иные болезни. Размеры текста, а также размеры кружков указывают на степень влияния факторов внешней среды на риски развития болезней.
Ранее, две независимые исследовательские группы, впервые, использовали полный сиквенс генома для диагностики в семьях с наследственными заболеваниями заболеваний на молекулярном уровне, (Roach, J.C. et al. 2010). Эти результаты можно считать первым фактом потенциального применения сиквенирования генома и персонализированной медицины, как части современной медицины. Новые доступные методы сиквенирования потенциально могут облегчить диагностику целого ряда заболеваний. Зная, какие мутации имеют место у каждого пациента, врачи получат возможность персонализировать лечение, выбирая в качестве мишеней терапии только дефектные молекулярные пути, таким путем минимизируя нежелательные побочные эффекты при лечении.
Таким образом, мы теперь можем не только сиквенировать последовательность всего генома человека, но и использовать эти данные в терапии каждого отдельного пациента. В сочетании с другими источниками информации, геном открывает возможности для прогнозирования наиболее распространенных болезней человека, и реакцию организма на то или иное лекарство. Геномы могут стать движущим фактором для персонализации медицинской помощи пациентам.
Персонализированной медициной является применение генетических и молекулярных данных в улучшении качества оказания медицинской помощи, содействии разработкам и клиническим испытаниям новых продуктов, помощи в определении предрасположенности человека к определенной болезни или состоянию, а также в разработке целевых стратегий профилактики болезней.
В дополнении к выявлению новых аллелей генов и кодирующих последовательностей, так или иначе связанных с развитием болезней, индивидуальными реакциями на препараты, а также взаимодействиям генов с окружающей средой, предрасположенность к болезням может определяться и различными этническими вариантами однонуклеотидного полиморфизма (SNP). Поэтому при оценке генетического риска определенных болезней знания генетических различий между этносами имеет немаловажное значение. На сегодняшний день, сиквенированы последовательности геномов людей трех различных географических регионов: йоруба Африки, двух индивидуумов северо-западного европейского происхождения, а также индивидуумов из Китая и Кореи.
До сих пор не сиквенированы геномы представителей казахов и других этнических групп, проживающих в Казахстане. Предполагается, что такая информация поможет выявить общие этнические генетические вариации, которые могут играть важную роль в генетической предрасположенности к определенным заболеваниям, распространенным в Казахстане.